The Innovation | 抗击新冠的"免疫原性增强型"减毒活疫苗
原创 XF Li & Z Cui TheInnovation创新 2022-03-10 00:01
导 读
新冠病毒仍在全球范围内持续流行和变异,奥密克戎等不断出现的“须关切变种”使得多数疫苗效力大打折扣。多项研究证实,自然感染诱导的免疫反应在应对变异株感染方面具有明显优势。作为经典疫苗技术路线之一的减毒活疫苗,可真实模拟病毒感染过程,激活机体全面的免疫反应。然而迄今仍未有新冠减毒活疫苗问世,研发安全有效的新冠减毒活疫苗仍然是生物医学领域面临的重大挑战。
图1 图文摘要
2020年初暴发的新冠肺炎疫情给世界政治、经济和人类生命健康带来巨大冲击,如何终结疫情已成为当今世界面临的共同问题。疫苗是预防传染病的最有效手段,目前获批上市的灭活、mRNA、腺病毒载体等多种新冠疫苗,为全球新冠疫情防控作出重大贡献。然而,随着奥密克戎等“须关切变种”的不断出现,突破性感染的病例数持续增加,临床数据显示多数疫苗效力显著降低,迫切需要研发新型疫苗。多项研究证实,新冠病毒自然感染诱导的免疫反应在应对变异株感染方面具有明显优势。减毒活疫苗作为最经典的疫苗技术路线之一,能真实再现病毒感染全过程,刺激机体产生粘膜、体液和细胞免疫应答,最终提供全面有效的免疫保护。研发安全有效的新冠减毒活疫苗意义重大。
2022年3月1日,军事科学院军事医学研究院联合中国科学院生物物理研究所等单位,在The Innovation杂志在线发表题为“A highly immunogenic live-attenuated vaccine candidate prevents SARS-CoV-2 infection and transmission in hamsters”的研究论文。研究人员成功获得一种新冠病毒减毒株VAS5,并发现单剂次滴鼻途径免疫即可在仓鼠模型中有效阻断病毒感染和传播。
研究者在专门用于疫苗生产的Vero细胞中对新冠病毒进行连续传代培养,经深度测序后发现,新冠病毒传代过程中在其刺突蛋白S1/S2连接处发生一系列缺失突变,其中缺失7个氨基酸(NSPRRAR)的突变株VAS5逐渐成为绝对主体,与野生株相比显示出明显的复制竞争优势(图2)。
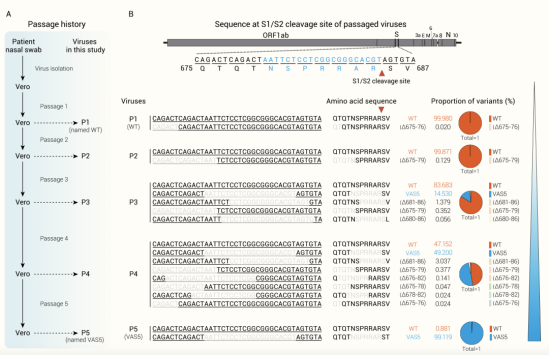
图2 新冠病毒S蛋白S1/S2区在细胞中连续传代后的基因变异特征
进一步比较其与野生型新冠病毒在不同人源体系中的复制能力,结果发现无论是在人类细胞系Huh7和Caco-2,还是在人肺和气管类器官,突变株VAS5的复制效率较野生型病毒均显著下降,显示出其对人体具有明确的减毒特征(图3)
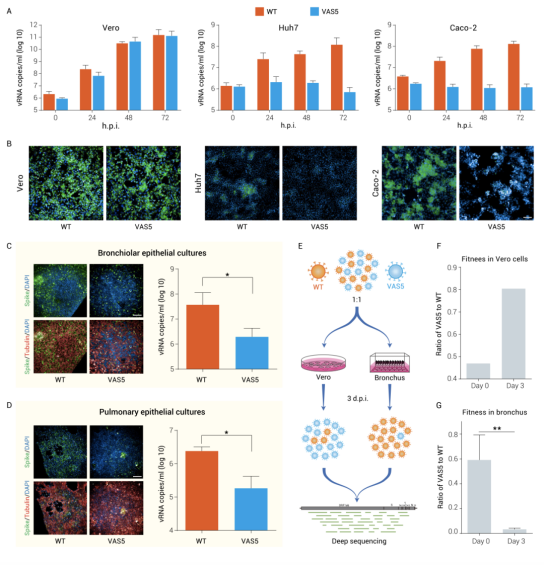
图3 7个氨基酸缺失的突变株VAS5对哺乳动物和人的减毒特征
为了验证VAS5能否成为有效的候选减毒活疫苗,研究者进一步利用仓鼠感染和传播模型评价了VAS5的免疫保护效果。结果表明,经滴鼻途径免疫VAS5的仓鼠在接种新冠病毒后,其气管、肺组织中的病毒核酸载量明显低于未免疫组仓鼠,显示出有效的免疫保护效果(图4)。
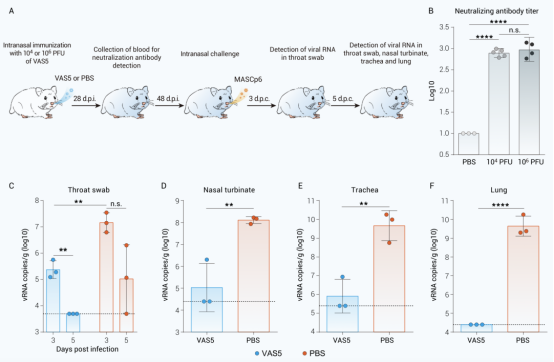
图4 减毒株VAS5单针免疫能够保护仓鼠免受新冠病毒感染
更重要的是,VAS5免疫不仅使动物自身得到有效保护,其将病毒传播至正常仓鼠的能力也完全丧失,表明单剂次免疫减毒活疫苗VAS5具备阻断新冠病毒传播的能力(图5)。
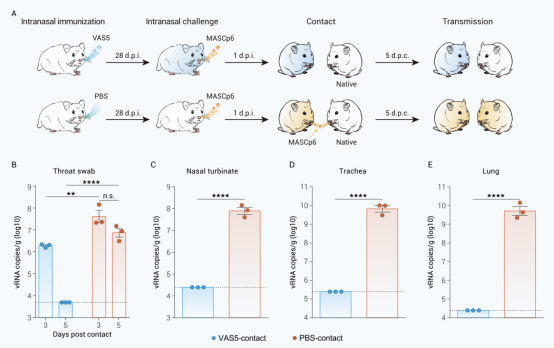
图5 减毒株VAS5单针免疫能够阻断新冠病毒在仓鼠间传播
有趣的是,热稳定性和酶解稳定性分析显示,疫苗株VAS5的S蛋白与野生型病毒相比具有更加稳定的特性;尤其在大鼠模型中能诱导更高水平的IgG抗体(图6),显示出明显的免疫增强特征。
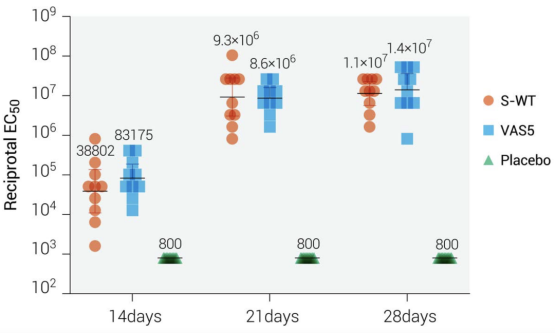
图6 减毒株VAS5 S蛋白能诱导大鼠产生更强的体液免疫反应
为探明其结构生物学基础,研究人员分别解析了野生型和减毒株VAS5的S蛋白三聚体结构,结果发现两种S蛋白均存在闭合构象(3.6 Å)和开放构象(4.2 Å),而减毒株VAS5的闭合构象占比显著增加。进一步分析二者受体结合域RBD的结构特点,结果显示,VAS5的闭合状态S蛋白中的三个RBD更加紧密(图7),呈现出类似于新冠重组S蛋白疫苗(Novavax公司)的结构特征,表明VAS5的S蛋白具备良好的抗原性。
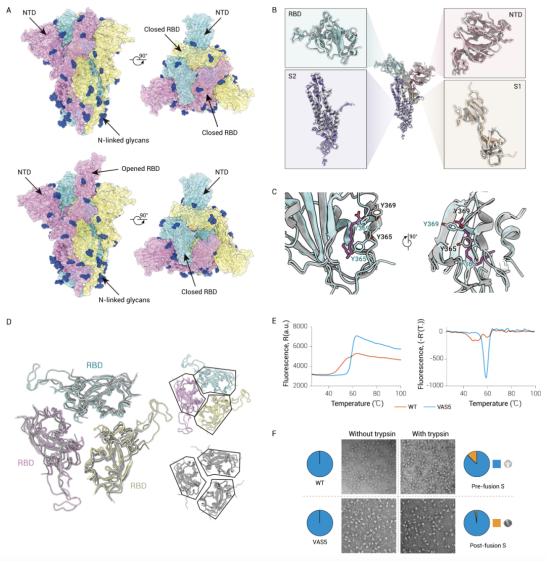
图7 减毒株VAS5 S蛋白的RBD能形成更稳定的紧致结构
总结与展望
本研究获得了一种安全有效的新冠病毒减毒活疫苗候选株,并系统阐明了其减毒和诱导高效免疫保护应答的作用机制,不仅为防控新冠疫情提供了可能的新手段,也为“下一代”超强抗原性新冠疫苗的设计提供了新思路。

扫二维码|查看原文
原文链接:
https://www.cell.com/the-innovation/fulltext/S2666-6758(22)00017-0
本文内容来自Cell Press合作期刊The Innovation第三卷第二期以Report发表的“A highly immunogenic live-attenuated vaccine candidate prevents SARS-CoV-2 infection and transmission in hamsters” (投稿: 2021-11-11;接收: 2022-02-28;在线刊出: 2022-03-01)。
DOI: https://doi.org/10.1016/j.xinn.2022.100221
引用格式:Li X., Cui Z., Fan H., et al. (2022). A highly immunogenic live-attenuated vaccine candidate prevents SARS-CoV-2 infection and transmission in hamsters. The Innovation. 3(2),100221.
作者简介

李晓峰,军事科学院军事医学研究院研究员,课题组组长,北京市科技新星。一直从事虫媒黄病毒等烈性RNA病毒防治应用基础研究,以第一或共同第一作者在Cell、Lancet Infect Dis、Cell Res等国际期刊发表SCI论文20余篇。曾获梅里埃基金会 ADVAC fellowship。先后获广州市科技进步一等奖1项、军队科技进步一等奖2项和北京市自然科学一等奖1项,获授权发明专利6项。

崔玉军,军事科学院军事医学研究院研究员,多年来致力于微生物进化和基因组流行病学研究。应用进化理论研究成果,对鼠疫菌、副溶血弧菌、新冠病毒等重要病原开展传播规律和溯源分析,为解答病原监测与防控关键科学问题做出积极贡献。发表研究论文百余篇,代表性工作发表于The New England Journal of Medicine、PNAS(2013,2015,2021)、ISME Journal等杂志。曾获军队科技进步一等奖、新疆维吾尔自治区科技进步一等奖等。

王祥喜,中国科学院生物物理研究所研究员,感染与免疫重点实验室副主任。一直聚焦国家公共健康重大需求,围绕重大疾病直接相关的病毒颗粒结构与功能开展系统研究,揭示病毒感染与免疫机制和致病机理,并基于结构信息开发疫苗和超敏诊断技术。以通讯作者在Science、Nature、Cell等杂志发表论文50余篇,被引次数5000余次。相关研究成果被评选为 “2020年中国科学十大进展”、“2019年中国科学十大进展”、“2019年中国科技十大新闻”以及“2018年中国生命科学十大进展”等荣誉。

秦成峰,军事科学院军事医学研究院研究员,国家杰出青年基金获得者。主要从事新发病毒的防控基础与疫苗研发研究。以通讯作者(含共同通讯)在Science、Cell和Nature等期刊发表论文150余篇,累计被引超过12000 次,入选科睿唯安“全球高被引科学家”、爱思唯尔“中国高被引科学家”。曾获中国青年科技奖、求是杰出青年奖(实用工程奖)、谈家桢生命科学创新奖和药明康德生命化学杰出成就奖,领衔获北京市自然科学一等奖和军队科技进步一等奖各1项,获批临床试验批件和军特药批件多项。