雾化吸入抗体:新冠治疗的新型武器?
原创 Zhenlin Yang TheInnovation创新
导读
近日,新冠疫情呈现多点散发、多地频发的态势,疫情防控形势严峻复杂,社会各界翘首期盼新冠特效药。截至目前,已有10多种单克隆抗体药物获得欧盟或美国药监局等紧急授权(EUA)。作为治疗新冠的重要方式之一,注射给药的抗体药物仍然存在缺陷,如肺部利用率较低、肺部药物浓度攀升至峰值所需时间较长等。复旦大学吴艳玲团队深入探讨了雾化吸入与注射给药两种方式的区别,为后续新冠抗体药物设计及给药方式的选择提供新的思路。
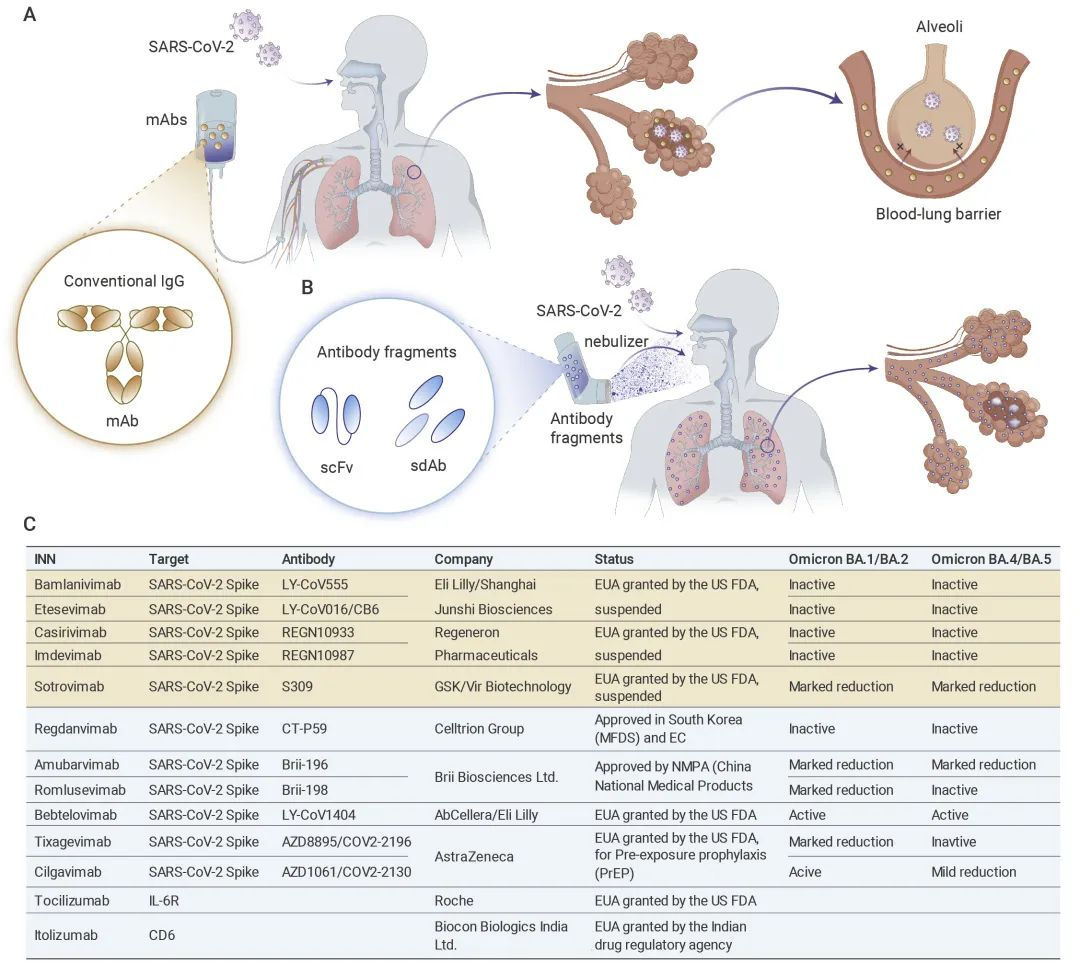
图1 图文摘要
病原体引起的急性呼吸系统感染位列2019年全球十大致死原因第四位。其中,流感病毒、呼吸道合胞病毒等长期以来严重危害人类生命健康。2020年以来,新冠病毒更是给公众健康带来巨大威胁,给社会经济带来巨大冲击。针对呼吸系统感染的抗体药物的成功案例仍属凤毛麟角,相关药物达不到有效的临床终点及高昂的药物成本可能是未获成功的关键。
呼吸道病毒,如呼吸道合胞病毒、流感病毒、冠状病毒等,优先在呼吸道表面的纤毛细胞中传播,沉积在上呼吸道的病毒可进一步通过气道粘液扩散,并通过与受体结合而入侵气道上皮细胞。因此病毒感染的路径是从上呼吸道转移至下呼吸道,最后到达肺部深处,这也解释了为何在病毒侵染初期使用鼻咽拭子检测比血液检测更为灵敏。感染后期,病毒的持续扩增引起的炎症反应进一步导致上皮细胞损伤,从而使病毒长驱直入,侵染肺泡细胞。而当病毒一旦进入血液产生病毒血症,往往伴随着剧烈的炎症反应和肺部损伤,表现为呼吸困难等临床症状。鉴于病毒的复制特征,抗体必须能够快速精准到达气道才能高效中和大量的病毒复制。因此,现阶段很多新冠抗体药物如LY-COV555、REGN-COV2等,在感染初期病人体内用药效果明显好于感染后期的重症病人,以至于这些药物治疗窗口较窄。究其原因,此类抗体药物主要通过注射给药,由于抗体从全身血液循环进入肺泡需要穿透气血屏障,往往到达肺内后浓度很低。例如,在注射流感抗体的病人体内,肺泡灌洗液(BALF)中的抗体浓度甚至不到血液中的千分之二。相反,通过雾化吸入的给药方式直接将抗体药物经由呼吸道递送至肺泡,效率更高,速度更快。在新冠抗体1212C2的研究中,相较于注射给药,吸入给药将BALF中抗体的浓度提高了约170倍。较高的抗体利用率进一步降低抗体药物用量,减少成本并减轻副作用,因此可作为一种较为高效的治疗手段。
然而,雾化吸入的效率与抗体的分子量呈负相关关系。在到达肺泡之前,气道分支大约16~17次。粒子沉积主要受到粒子尺寸、重量及呼吸道气流的影响。大于5 μm的颗粒因重力和沉积作用,主要停留在上呼吸道,如喉部和气道,难以达到肺部深处;小于0.5 μm的颗粒则容易被气流呼出;颗粒尺寸在1~5 μm之间的药物可通过布朗运动扩散至下呼吸道,最适合雾化给药。由于传统的单克隆抗体分子量较大(约150 kDa),雾化后颗粒直径大于5 μm,导致肺组织中吸收率低。相较于传统的单克隆抗体,小分子的抗体片段,如单链抗体(scFv,分子量约25 kDa)及单域抗体(sdAb,分子量约12.5 kDa)因其较小的分子量,更适合做成颗粒尺寸在1~5 μm之间的雾化制剂,具备更高的雾化给药效率。
总结与展望
由于新冠病毒持续变异的特性,目前上市的大多数抗体药物对奥密克戎株已失去治疗作用。如何研发具备广谱、高效、经济且适合应对大规模疫情的抗体药物具有十分重要的意义。研究表明,靶向新冠病毒表面蛋白S的广谱位点,如茎部S2区域及三聚体S内表面的隐藏保守表位的小分子量抗体药物具有更高的广谱性,通过雾化吸入给药方式将提高抗体在肺部的浓度、提升响应速度、延长治疗窗口,有助于高效应对全球范围新冠疫情。
作者简介
吴艳玲,复旦大学基础医学院副研究员,上海合成免疫工程技术研究中心副主任,上海市“晨光学者”,在抗体药物研发以及创新型新结构抗体的工程改造等方面开展了系统性研究,近五年来在国际知名期刊Cell、Cell Host Microbe等发表40余篇SCI论文,完成2项成果转化,承担国家自然科学基金、上海市教委等研究项目。 |
应天雷,复旦大学基础医学院研究员,博士生导师,上海合成免疫工程技术研究中心主任,治疗性疫苗国家工程实验室执行主任,国家重点研发计划首席科学家。致力于重大传染病、恶性肿瘤、重大脑病等的领域新型合成免疫药物研发。在Cell、Nat Biotechnol等杂志发表SCI论文一百余篇,完成8项成果转化。 |
杨振霖,复旦大学附属中山医院呼吸内科青年研究员,硕士生导师,上海合成免疫工程技术研究中心副主任。主要研究方向为蛋白-药物分子复合物三维结构测定和基于结构分析及工程改造的成药性优化。在Nature、Cell、Cell Research等学术期刊发表20余篇研究论文;主持国家自然科学基金面上、上海市卫健委优秀青年人才项目等。 |